Medicamento con anticuerpos anti-COVID-19 de GlaxoSmithKline y Vir Biotechnology recibe la Autorización de Uso en Emergencias
|
Por el equipo editorial de HospiMedica en español Actualizado el 03 Jun 2021 |
Ilustración
GlaxoSmithKline plc (Londres, Reino Unido) y Vir Biotechnology, Inc. (San Francisco, CA, EUA) recibieron la Autorización de Uso en Emergencias (AUE) de la Administración de Alimentos y Medicamentos de EUA (FDA) para el sotrovimab (anteriormente VIR-7831) para el tratamiento de la COVID-19 leve a moderada en adultos y pacientes pediátricos de alto riesgo.
El sotrovimab es un anticuerpo monoclonal de dosis única en investigación que recibió una AUE por la FDA para el tratamiento de la COVID-19 leve a moderada en pacientes adultos y pediátricos (edad de 12 años y mayores que pesen al menos 40 kg) con resultados positivos de pruebas virales directas del SARS-CoV-2 y que tienen un alto riesgo de progresión a COVID-19 grave, incluida la hospitalización o la muerte. La AUE de la FDA tiene como objetivo facilitar la disponibilidad y el uso del anticuerpo monoclonal en investigación para el tratamiento de la COVID-19 en los EUA mientras que la pandemia se mantiene como una emergencia de salud pública. La hoja de datos de la FDA para proveedores de atención médica con respecto al uso de emergencia de sotrovimab refleja la definición recientemente actualizada de alto riesgo de COVID-19 para incluir afecciones médicas adicionales y factores asociados con un mayor riesgo de progresión a una enfermedad grave. La AUE para sotrovimab también incluye compromisos posteriores a la autorización según se especifica en la Carta de Autorización.
La AUE se otorgó a sotrovimab sobre la base de un análisis intermedio de los datos de eficacia y seguridad del ensayo Fase 3 COMET-ICE (ensayo de eficacia del anticuerpo monoclonal COVID-19 - Intención de cuidado temprano) en pacientes ambulatorios adultos de alto riesgo, que fue detenido anticipadamente por un comité de seguimiento de datos independiente en marzo de 2021 debido a la evidencia de una profunda eficacia clínica. Los resultados provisionales del estudio habían demostrado una reducción del 85% en la hospitalización durante más de 24 horas o la muerte en los que recibieron sotrovimab en comparación con el placebo, el criterio de valoración principal del ensayo. Los eventos adversos más comunes observados en el grupo de tratamiento con sotrovimab en COMET-ICE fueron erupción cutánea (2%) y diarrea (1%), todos los cuales fueron de Grado 1 (leve) o Grado 2 (moderado). No se informaron otros eventos adversos emergentes del tratamiento a una tasa mayor con sotrovimab en comparación con placebo. La AUE incluye una advertencia de hipersensibilidad, incluida la anafilaxia y las reacciones relacionadas con la infusión.
El sotrovimab se dirige a un epítopo conservado de la proteína Spike que es menos probable que mute con el tiempo. La presentación de la AUE también incluyó datos de estudios in vitro publicados, que demostraron que el sotrovimab mantiene la actividad contra todas las variantes circulantes conocidas que son motivo de preocupación. GSK y Vir continuarán evaluando la capacidad del sotrovimab para mantener la actividad frente a variantes nuevas y emergentes. Aún no se conoce el impacto clínico de estos datos de variantes in vitro. La recopilación y el análisis de datos aún están en curso. Se espera un análisis de los datos de seguridad y eficacia el día 29 para la población completa del ensayo COMET-ICE, desde la primera mitad de 2021. GSK y Vir planean presentar una Solicitud de Licencia de Biológicos (BLA) a la FDA en la segunda mitad de 2021.
“Nuestro enfoque científico distintivo ha llevado a un único anticuerpo monoclonal que, basado en un análisis intermedio, resultó en una reducción del 85% en las hospitalizaciones o muerte por cualquier causa, y demostró, in vitro, que conserva la actividad contra todas las variantes conocidas de preocupación, incluida la variante emergente de la India”, dijo George Scangos, Ph.D., director ejecutivo de Vir. “Creo que el sotrovimab es una nueva opción de tratamiento crítica en la lucha contra la pandemia actual y potencialmente también para futuros brotes de coronavirus. En Vir, nuestro objetivo no es solo ofrecer una terapia clínicamente eficaz para COVID-19, sino también proporcionar una terapia eficaz contra las variantes del SARS-CoV-2 y las posibles pandemias del mañana”.
“El ritmo rápido de las vacunas COVID-19 en los EUA es alentador; sin embargo, a pesar de estos esfuerzos agresivos, todavía existe la necesidad de ayudar a prevenir que los pacientes infectados desarrollen complicaciones”, dijo el Dr. Hal Barron, director científico y presidente de I+D. GSK. “En poco más de un año desde que comenzamos nuestra colaboración y en menos de 10 meses desde que comenzamos los ensayos clínicos, estamos encantados de que, a partir de hoy, los beneficios de este anticuerpo monoclonal único ahora estén disponibles para los pacientes que lo necesiten”.
Enlace relacionado:
GlaxoSmithKline plc
Vir Biotechnology, Inc.
El sotrovimab es un anticuerpo monoclonal de dosis única en investigación que recibió una AUE por la FDA para el tratamiento de la COVID-19 leve a moderada en pacientes adultos y pediátricos (edad de 12 años y mayores que pesen al menos 40 kg) con resultados positivos de pruebas virales directas del SARS-CoV-2 y que tienen un alto riesgo de progresión a COVID-19 grave, incluida la hospitalización o la muerte. La AUE de la FDA tiene como objetivo facilitar la disponibilidad y el uso del anticuerpo monoclonal en investigación para el tratamiento de la COVID-19 en los EUA mientras que la pandemia se mantiene como una emergencia de salud pública. La hoja de datos de la FDA para proveedores de atención médica con respecto al uso de emergencia de sotrovimab refleja la definición recientemente actualizada de alto riesgo de COVID-19 para incluir afecciones médicas adicionales y factores asociados con un mayor riesgo de progresión a una enfermedad grave. La AUE para sotrovimab también incluye compromisos posteriores a la autorización según se especifica en la Carta de Autorización.
La AUE se otorgó a sotrovimab sobre la base de un análisis intermedio de los datos de eficacia y seguridad del ensayo Fase 3 COMET-ICE (ensayo de eficacia del anticuerpo monoclonal COVID-19 - Intención de cuidado temprano) en pacientes ambulatorios adultos de alto riesgo, que fue detenido anticipadamente por un comité de seguimiento de datos independiente en marzo de 2021 debido a la evidencia de una profunda eficacia clínica. Los resultados provisionales del estudio habían demostrado una reducción del 85% en la hospitalización durante más de 24 horas o la muerte en los que recibieron sotrovimab en comparación con el placebo, el criterio de valoración principal del ensayo. Los eventos adversos más comunes observados en el grupo de tratamiento con sotrovimab en COMET-ICE fueron erupción cutánea (2%) y diarrea (1%), todos los cuales fueron de Grado 1 (leve) o Grado 2 (moderado). No se informaron otros eventos adversos emergentes del tratamiento a una tasa mayor con sotrovimab en comparación con placebo. La AUE incluye una advertencia de hipersensibilidad, incluida la anafilaxia y las reacciones relacionadas con la infusión.
El sotrovimab se dirige a un epítopo conservado de la proteína Spike que es menos probable que mute con el tiempo. La presentación de la AUE también incluyó datos de estudios in vitro publicados, que demostraron que el sotrovimab mantiene la actividad contra todas las variantes circulantes conocidas que son motivo de preocupación. GSK y Vir continuarán evaluando la capacidad del sotrovimab para mantener la actividad frente a variantes nuevas y emergentes. Aún no se conoce el impacto clínico de estos datos de variantes in vitro. La recopilación y el análisis de datos aún están en curso. Se espera un análisis de los datos de seguridad y eficacia el día 29 para la población completa del ensayo COMET-ICE, desde la primera mitad de 2021. GSK y Vir planean presentar una Solicitud de Licencia de Biológicos (BLA) a la FDA en la segunda mitad de 2021.
“Nuestro enfoque científico distintivo ha llevado a un único anticuerpo monoclonal que, basado en un análisis intermedio, resultó en una reducción del 85% en las hospitalizaciones o muerte por cualquier causa, y demostró, in vitro, que conserva la actividad contra todas las variantes conocidas de preocupación, incluida la variante emergente de la India”, dijo George Scangos, Ph.D., director ejecutivo de Vir. “Creo que el sotrovimab es una nueva opción de tratamiento crítica en la lucha contra la pandemia actual y potencialmente también para futuros brotes de coronavirus. En Vir, nuestro objetivo no es solo ofrecer una terapia clínicamente eficaz para COVID-19, sino también proporcionar una terapia eficaz contra las variantes del SARS-CoV-2 y las posibles pandemias del mañana”.
“El ritmo rápido de las vacunas COVID-19 en los EUA es alentador; sin embargo, a pesar de estos esfuerzos agresivos, todavía existe la necesidad de ayudar a prevenir que los pacientes infectados desarrollen complicaciones”, dijo el Dr. Hal Barron, director científico y presidente de I+D. GSK. “En poco más de un año desde que comenzamos nuestra colaboración y en menos de 10 meses desde que comenzamos los ensayos clínicos, estamos encantados de que, a partir de hoy, los beneficios de este anticuerpo monoclonal único ahora estén disponibles para los pacientes que lo necesiten”.
Enlace relacionado:
GlaxoSmithKline plc
Vir Biotechnology, Inc.
Últimas COVID-19 noticias
- Sistema de bajo costo detecta el virus SARS-CoV-2 en el aire del hospital mediante burbujas de alta tecnología
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- TC del tórax de los pacientes con COVID-19 podrían ayudar a diferenciar entre las variantes del SARS-CoV-2
- Resonancia magnética especializada detecta anormalidades pulmonares en pacientes no hospitalizados con COVID prolongada
- Algoritmo de IA identifica a los pacientes hospitalizados con mayor riesgo de morir por COVID-19
- Estudio evalúa el impacto de la COVID-19 sobre la gammagrafía de ventilación/perfusión
- Sensor de sudor detecta biomarcadores claves que suministran una alarma precoz de la COVID-19 y la influenza
- Modelo de IA para seguimiento de COVID-19 predice mortalidad durante los primeros 30 días del ingreso
- ECG puede señalar pacientes hospitalizados con COVID-19 con riesgo más alto de muerte
- IA predice pronóstico de COVID a un nivel casi experto con base en tomografías computarizadas
- Examen de TC muestra evidencia de daño pulmonar persistente mucho tiempo después de neumonía por COVID-19
- Plataforma órgano-en-un-chip ayuda a diseñar estrategia para tratar complicaciones severas de la COVID-19
Canales
Cuidados Criticos
ver canal
Nueva tecnología podría revolucionar atención de valvulopatías cardíacas
La valvulopatía, que afecta la función de cualquiera de las cuatro válvulas del corazón, impacta al 2,5 % de la población estadounidense y al 13 % de las personas de... Más
Dispositivo electrónico portátil súper permeable permite monitorear bioseñales a largo plazo
Los dispositivos electrónicos portátiles se han convertido en una parte integral de la mejora de la salud y el estado físico al ofrecer un seguimiento continuo de señales f... Más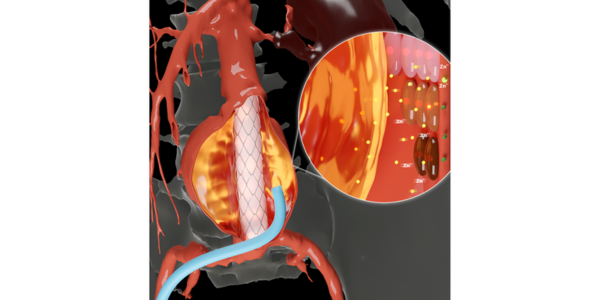
Nuevo hidrogel con capacidades mejoradas para tratar aneurismas y detener su progresión
Los aneurismas pueden desarrollarse en vasos sanguíneos de diferentes áreas del cuerpo, a menudo como resultado de aterosclerosis, infecciones, enfermedades inflamatorias y otros factores de riesgo.... MásNueva herramienta de IA predice eventos médicos para respaldar toma de decisiones clínicas en entornos de atención médica
En un nuevo estudio, los investigadores han demostrado el potencial de una nueva herramienta de inteligencia artificial (IA) para pronosticar la trayectoria de salud de un paciente mediante la predicción... MásTécnicas Quirúrgicas
ver canal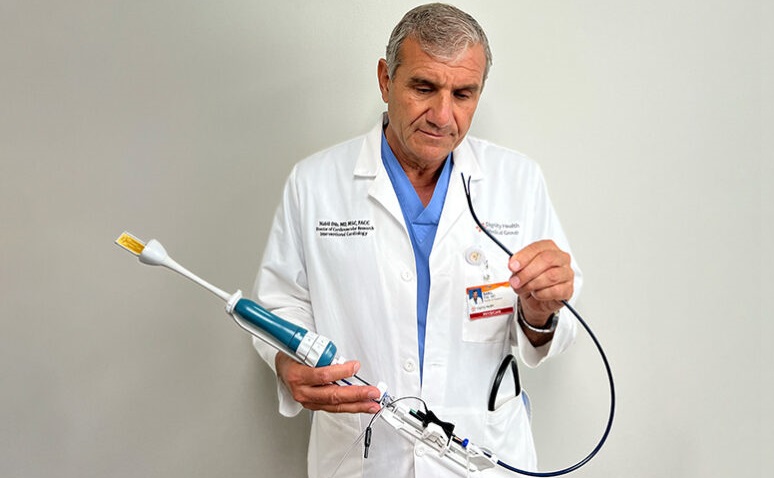
Nuevo sistema de catéter permite procedimientos transeptales más seguros y rentables
En 2021, los cardiólogos realizaron alrededor de 375.000 procedimientos transeptales del corazón izquierdo en los EUA, incluidos cierres, valvuloplastia, reparaciones, septostomías... Más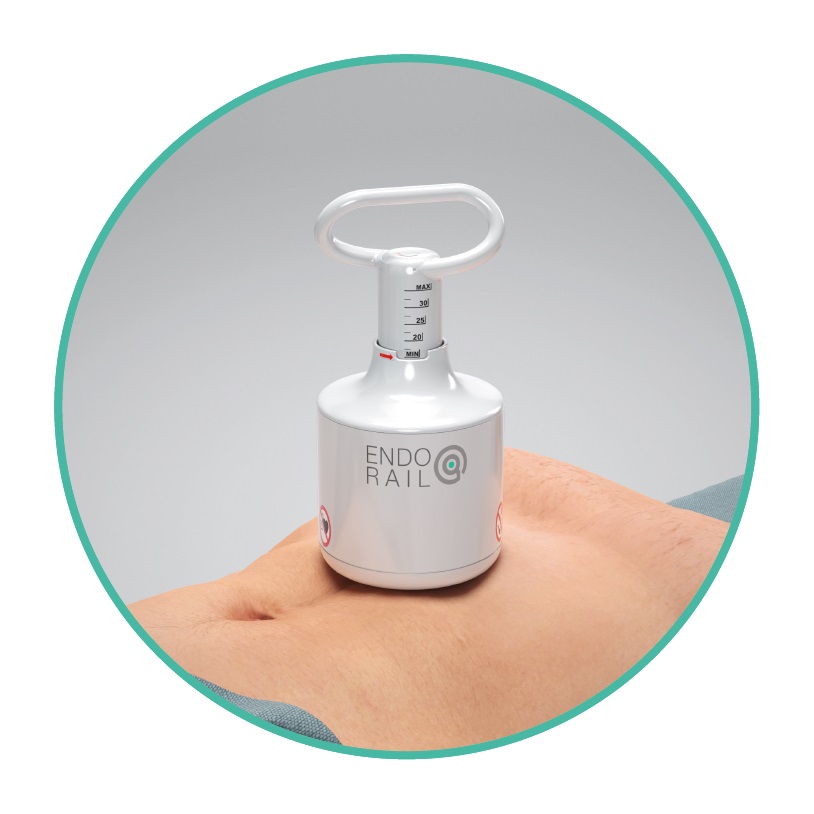
Tecnología de balón magnético optimiza resultados del procedimiento de colonoscopia
La colonoscopia es un procedimiento clave para diagnosticar, monitorear, prevenir y tratar diversas afecciones del colon, como el cáncer colorrectal y las enfermedades inflamatorias intestinales... Más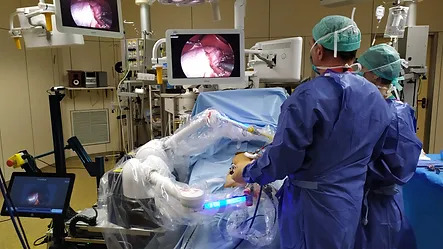
Sistema de cirugía robótica con capacidad basada en visión por computadora allana el camino para laparoscopia de próxima generación
La laparoscopia es una técnica quirúrgica en la que los cirujanos operan a través de pequeñas incisiones con una cámara interna e instrumentos. Ahora, una novedosa t... MásCuidados de Pacientes
ver canal
Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
Una solución innovadora tiene la capacidad de transformar la utilización de la capacidad quirúrgica al atacar la causa raíz de las ineficiencias los bloques de tiempo quirúrgico.... Más
Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
Una innovación revolucionaria permite a los hospitales mejorar significativamente el tiempo de procesamiento de instrumentos y el rendimiento en quirófanos y departamentos de procesamiento... Más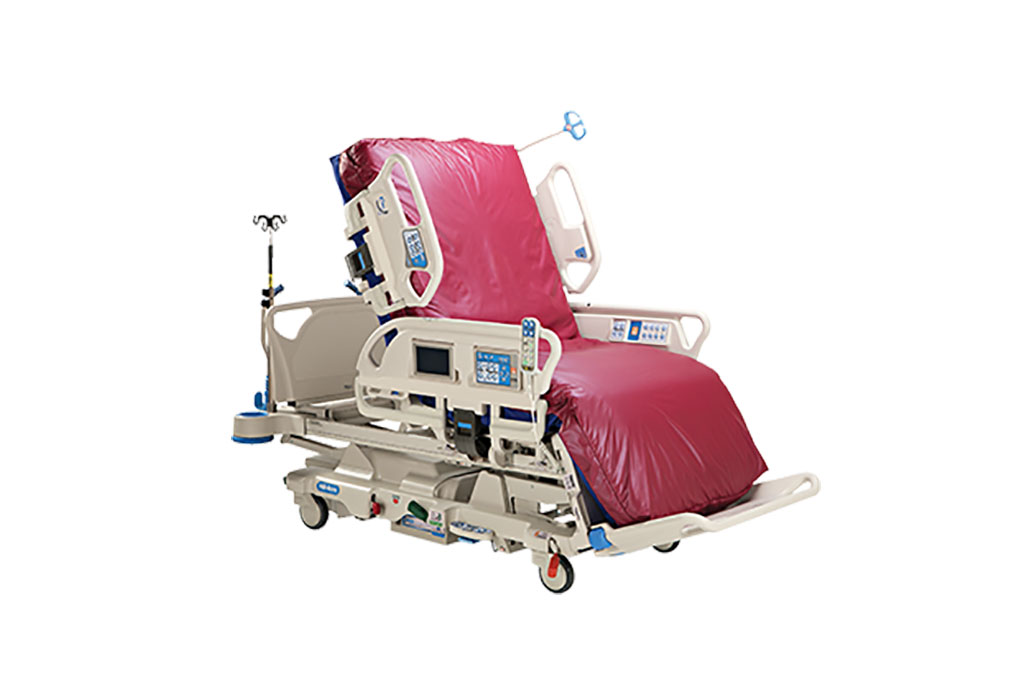
Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
A medida que el entorno de cuidados intensivos se vuelve cada vez más exigente y complejo debido a las cambiantes necesidades de los hospitales, existe una necesidad apremiante de innovaciones que... MásTI
ver canal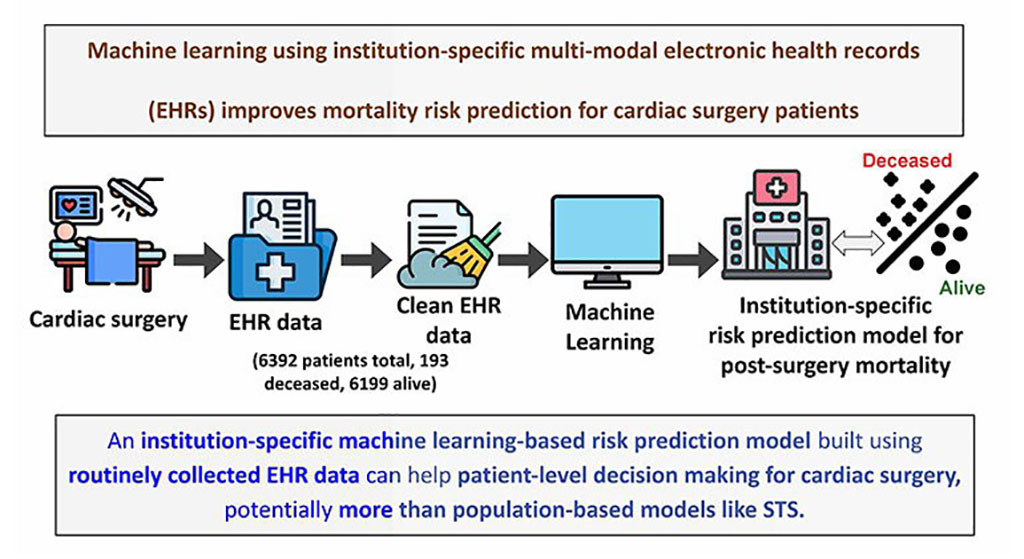
Modelo de aprendizaje automático mejora predicción del riesgo de mortalidad para pacientes de cirugía cardíaca
Se han implementado algoritmos de aprendizaje automático para crear modelos predictivos en varios campos médicos, y algunos han demostrado mejores resultados en comparación con sus... Más
Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
Los más altos expertos de la industria han subrayado el requisito inmediato de que los sistemas de salud y los hospitales respondan a las severas presiones de costos y márgenes.... MásPruebas POC
ver canal
Lector de inmunoensayo de pruebas POC proporciona análisis cuantitativo de kits de prueba para diagnóstico más preciso
Un lector de inmunoensayos cuantitativos pequeño y liviano que proporciona un análisis cuantitativo de cualquier tipo de kits o tiras de prueba rápida, y se puede conectar a una PC... Más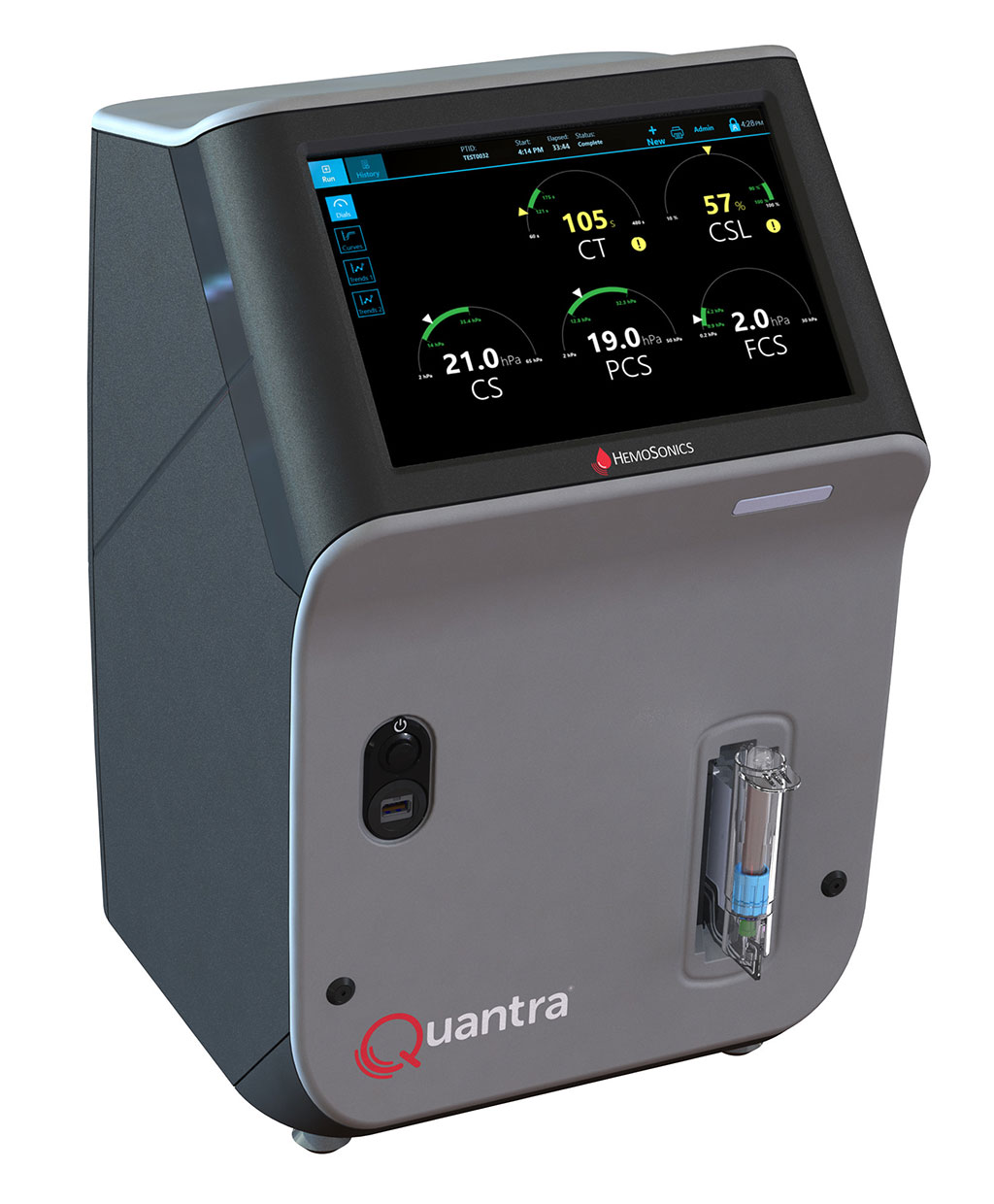
Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
Las pruebas hemostáticas actuales proporcionan solo un subconjunto de la información necesaria, o tardan demasiado en ser útiles en situaciones críticas de hemorragia, lo que... Más
Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
La resistencia a los antimicrobianos (RAM) es la falta de respuesta de las bacterias a un determinado antibiótico debido a mutaciones o genes de resistencia que la especie ha adquirido.... MásNegocios
ver canal
Mindray adquirirá empresa china de dispositivos médicos APT Medical
Un reciente análisis exhaustivo de la industria ha demostrado que el mercado cardiovascular mundial ha alcanzado una valoración de 56 mil millones de dólares. En particular, el segmento... Más