Vacuna de Pfizer-BioNTech contra la COVID-19 se convierte en la primera en recibir la Autorización para Uso en Emergencias
|
Por el equipo editorial de HospiMedica en español Actualizado el 15 Dec 2020 |
Ilustración
La Administración de Alimentos y Medicamentos de EUA (FDA) autorizó el uso de emergencia de la vacuna de ARNm, BNT162b2 de Pfizer Inc. (Nueva York, NY, EUA) y Biopharmaceutical New Technologies (BioNTech Maguncia, Alemania), lo que marca la primera autorización histórica en EUA de una vacuna para prevenir la COVID-19.
La vacuna quedó autorizada bajo una Autorización para Uso en Emergencias (AUE), mientras que Pfizer y BioNTech recopilan datos adicionales y se preparan para presentar una solicitud de licencia de biológicos (BLA) planificada, ante la FDA, para una posible aprobación regulatoria completa en 2021. La FDA basó su decisión en la totalidad de la evidencia científica compartida por las empresas, incluidos los datos de un estudio clínico fundamental de fase 3 anunciado en noviembre y publicado en la revista The New England Journal of Medicine.
Los datos de la Fase 3 demostraron una tasa de eficacia de la vacuna del 95% en participantes sin infección previa por SARS-CoV-2 (primer objetivo primario) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), en cada caso medido siete días después de la segunda dosis. El Comité de Monitoreo de Datos del estudio no ha informado de ningún problema de seguridad serio relacionado con la vacuna. La eficacia fue constante según la edad, el género, la raza y la etnia. Todos los participantes del ensayo continuarán en seguimiento para evaluar la protección y seguridad a largo plazo durante dos años adicionales después de su segunda dosis.
En julio de 2020, Pfizer y BioNTech anunciaron un acuerdo con el HHS y el Departamento de Defensa para cumplir con el objetivo del programa Operación Warp Speed, del gobierno de EUA, de administrar dosis de una vacuna para la COVID-19. Con la vacuna autorizada para uso de emergencia en los EUA, las empresas comenzarán a aplicar las primeras dosis en los EUA de inmediato, y se espera que la aplicación de la vacuna se complete en 2021.
“El propósito de Pfizer son los avances que cambian la vida de los pacientes, y en nuestros 171 años de historia nunca ha habido una necesidad más urgente de un avance que hoy, con cientos de miles de personas que continúan sufriendo de COVID-19”, dijo Albert Bourla. Presidente y Director Ejecutivo de Pfizer. “Como empresa estadounidense, la noticia de hoy es un gran orgullo y una gran alegría porque Pfizer superó el desafío de desarrollar una vacuna que tenga el potencial de ayudar a poner fin a esta devastadora pandemia. Hemos trabajado incansablemente para hacer posible lo imposible, firmes en nuestra creencia de que la ciencia vencerá”.
“Fundamos BioNTech para desarrollar nuevas tecnologías y medicamentos que utilizan todo el potencial del sistema inmunológico para combatir enfermedades graves”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Hoy estamos un paso más cerca de nuestra visión. Creemos que la Autorización para Uso en Emergencias de hoy y la posterior distribución de nuestra vacuna, que ha demostrado una tasa de eficacia del 95% y un perfil de seguridad favorable, ayudarán a salvar vidas en los Estados Unidos y podrían acelerar el regreso a la normalidad”.
“La autorización de la FDA para uso en emergencias de la primera vacuna contra la COVID-19 es un hito importante en la lucha contra esta pandemia devastadora que ha afectado a tantas familias en los Estados Unidos y en todo el mundo”, dijo el comisionado de la FDA, Stephen M. Hahn, MD. “La acción de hoy es posterior a un proceso de revisión abierto y transparente que incluyó aportes de científicos independientes y expertos en salud pública y una evaluación exhaustiva por parte de los científicos de carrera de la agencia para garantizar que esta vacuna cumpla con los estándares científicos rigurosos de la FDA para la seguridad, eficacia y calidad de fabricación necesarias para respaldar la autorización de uso en emergencias. El trabajo incansable para desarrollar una nueva vacuna para prevenir esta enfermedad nueva, grave y potencialmente mortal, en un período de tiempo acelerado después de su aparición, es un verdadero testimonio de la innovación científica y la colaboración público-privada en todo el mundo”.
Enlace relacionado:
Biopharmaceutical New Technologies
La vacuna quedó autorizada bajo una Autorización para Uso en Emergencias (AUE), mientras que Pfizer y BioNTech recopilan datos adicionales y se preparan para presentar una solicitud de licencia de biológicos (BLA) planificada, ante la FDA, para una posible aprobación regulatoria completa en 2021. La FDA basó su decisión en la totalidad de la evidencia científica compartida por las empresas, incluidos los datos de un estudio clínico fundamental de fase 3 anunciado en noviembre y publicado en la revista The New England Journal of Medicine.
Los datos de la Fase 3 demostraron una tasa de eficacia de la vacuna del 95% en participantes sin infección previa por SARS-CoV-2 (primer objetivo primario) y también en participantes con y sin infección previa por SARS-CoV-2 (segundo objetivo primario), en cada caso medido siete días después de la segunda dosis. El Comité de Monitoreo de Datos del estudio no ha informado de ningún problema de seguridad serio relacionado con la vacuna. La eficacia fue constante según la edad, el género, la raza y la etnia. Todos los participantes del ensayo continuarán en seguimiento para evaluar la protección y seguridad a largo plazo durante dos años adicionales después de su segunda dosis.
En julio de 2020, Pfizer y BioNTech anunciaron un acuerdo con el HHS y el Departamento de Defensa para cumplir con el objetivo del programa Operación Warp Speed, del gobierno de EUA, de administrar dosis de una vacuna para la COVID-19. Con la vacuna autorizada para uso de emergencia en los EUA, las empresas comenzarán a aplicar las primeras dosis en los EUA de inmediato, y se espera que la aplicación de la vacuna se complete en 2021.
“El propósito de Pfizer son los avances que cambian la vida de los pacientes, y en nuestros 171 años de historia nunca ha habido una necesidad más urgente de un avance que hoy, con cientos de miles de personas que continúan sufriendo de COVID-19”, dijo Albert Bourla. Presidente y Director Ejecutivo de Pfizer. “Como empresa estadounidense, la noticia de hoy es un gran orgullo y una gran alegría porque Pfizer superó el desafío de desarrollar una vacuna que tenga el potencial de ayudar a poner fin a esta devastadora pandemia. Hemos trabajado incansablemente para hacer posible lo imposible, firmes en nuestra creencia de que la ciencia vencerá”.
“Fundamos BioNTech para desarrollar nuevas tecnologías y medicamentos que utilizan todo el potencial del sistema inmunológico para combatir enfermedades graves”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Hoy estamos un paso más cerca de nuestra visión. Creemos que la Autorización para Uso en Emergencias de hoy y la posterior distribución de nuestra vacuna, que ha demostrado una tasa de eficacia del 95% y un perfil de seguridad favorable, ayudarán a salvar vidas en los Estados Unidos y podrían acelerar el regreso a la normalidad”.
“La autorización de la FDA para uso en emergencias de la primera vacuna contra la COVID-19 es un hito importante en la lucha contra esta pandemia devastadora que ha afectado a tantas familias en los Estados Unidos y en todo el mundo”, dijo el comisionado de la FDA, Stephen M. Hahn, MD. “La acción de hoy es posterior a un proceso de revisión abierto y transparente que incluyó aportes de científicos independientes y expertos en salud pública y una evaluación exhaustiva por parte de los científicos de carrera de la agencia para garantizar que esta vacuna cumpla con los estándares científicos rigurosos de la FDA para la seguridad, eficacia y calidad de fabricación necesarias para respaldar la autorización de uso en emergencias. El trabajo incansable para desarrollar una nueva vacuna para prevenir esta enfermedad nueva, grave y potencialmente mortal, en un período de tiempo acelerado después de su aparición, es un verdadero testimonio de la innovación científica y la colaboración público-privada en todo el mundo”.
Enlace relacionado:
Biopharmaceutical New Technologies
Últimas COVID-19 noticias
- Sistema de bajo costo detecta el virus SARS-CoV-2 en el aire del hospital mediante burbujas de alta tecnología
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- TC del tórax de los pacientes con COVID-19 podrían ayudar a diferenciar entre las variantes del SARS-CoV-2
- Resonancia magnética especializada detecta anormalidades pulmonares en pacientes no hospitalizados con COVID prolongada
- Algoritmo de IA identifica a los pacientes hospitalizados con mayor riesgo de morir por COVID-19
- Estudio evalúa el impacto de la COVID-19 sobre la gammagrafía de ventilación/perfusión
- Sensor de sudor detecta biomarcadores claves que suministran una alarma precoz de la COVID-19 y la influenza
- Modelo de IA para seguimiento de COVID-19 predice mortalidad durante los primeros 30 días del ingreso
- ECG puede señalar pacientes hospitalizados con COVID-19 con riesgo más alto de muerte
- IA predice pronóstico de COVID a un nivel casi experto con base en tomografías computarizadas
- Examen de TC muestra evidencia de daño pulmonar persistente mucho tiempo después de neumonía por COVID-19
- Plataforma órgano-en-un-chip ayuda a diseñar estrategia para tratar complicaciones severas de la COVID-19
Canales
Cuidados Criticos
ver canal
Una cápsula inteligente ingerible detecta sustancias químicas en el intestino
Los gases intestinales se asocian con diversas afecciones, como el cáncer de colon, el síndrome del intestino irritable y la enfermedad inflamatoria intestinal, y tienen el potencial de servir... Más
Nuevo método administra terapias celulares en pacientes críticos con soporte pulmonar externo
Hasta ahora, ha sido prácticamente imposible administrar terapias celulares a pacientes conectados a oxigenación por membrana extracorpórea (ECMO), un sistema de soporte vital utilizado... Más
Tecnología de IA generativa detecta enfermedades cardíacas antes que los métodos convencionales
Detectar disfunciones cardíacas de forma temprana utilizando herramientas rentables y de fácil acceso, como los electrocardiogramas (ECG), y derivar eficazmente a los pacientes adecuados... Más
Dispositivo portátil de monitoreo de salud mide los gases emitidos y absorbidos por la piel
La piel desempeña un papel vital en la protección de nuestro cuerpo frente a los elementos externos. Un componente clave de esta función protectora es la barrera cutánea, compuesta por proteínas y grasas... MásTécnicas Quirúrgicas
ver canal
Tecnología de bypass coronario sin suturas elimina la necesidad de cirugías a corazón abierto
En pacientes con enfermedad de las arterias coronarias, ciertos vasos sanguíneos pueden estar estrechados o bloqueados, lo que requiere la colocación de un stent o la realización de... Más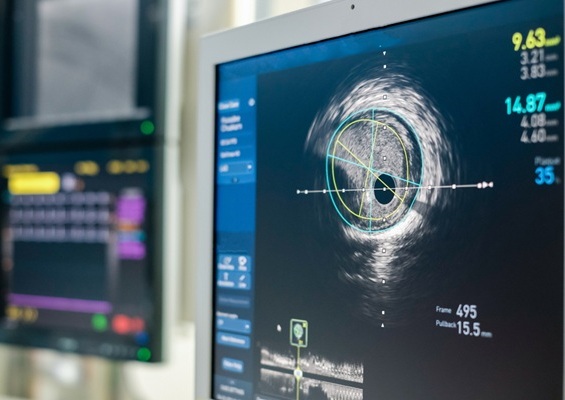
Las imágenes intravasculares mejoran la seguridad en la implantación de stents
Los pacientes diagnosticados con enfermedad coronaria arterial, causada por la acumulación de placa en las arterias, se someten con frecuencia a una intervención coronaria percutánea (ICP).... MásCuidados de Pacientes
ver canal
Plataforma de biosensores portátiles reducirá infecciones adquiridas en el hospital
En la Unión Europea, aproximadamente 4 millones de pacientes adquieren infecciones asociadas a la atención de la salud (IAAS), o infecciones nosocomiales, cada año, lo que provoca alrededor de 37.... MásTecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
La reducción de las infecciones adquiridas en la atención sanitaria (IAAS) sigue siendo una cuestión apremiante dentro de los sistemas sanitarios mundiales. Sólo en Estados Unidos, 1,7 millones de pacientes... Más
Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
Una solución innovadora tiene la capacidad de transformar la utilización de la capacidad quirúrgica al atacar la causa raíz de las ineficiencias los bloques de tiempo quirúrgico.... Más
Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
Una innovación revolucionaria permite a los hospitales mejorar significativamente el tiempo de procesamiento de instrumentos y el rendimiento en quirófanos y departamentos de procesamiento... MásTI
ver canal
Nanopartículas imprimibles permiten la producción masiva de biosensores portátiles
Es probable que el futuro de la medicina se centre en la personalización de la atención médica, comprendiendo exactamente lo que cada individuo necesita y proporcionando la combinación... Más
Los relojes inteligentes podrían detectar la insuficiencia cardíaca congestiva
El diagnóstico de la insuficiencia cardíaca congestiva (ICC) suele requerir técnicas de diagnóstico por imagen costosas y que consumen mucho tiempo, como la ecocardiografía,... MásPruebas POC
ver canal
Lector de inmunoensayo de pruebas POC proporciona análisis cuantitativo de kits de prueba para diagnóstico más preciso
Un lector de inmunoensayos cuantitativos pequeño y liviano que proporciona un análisis cuantitativo de cualquier tipo de kits o tiras de prueba rápida, y se puede conectar a una PC... Más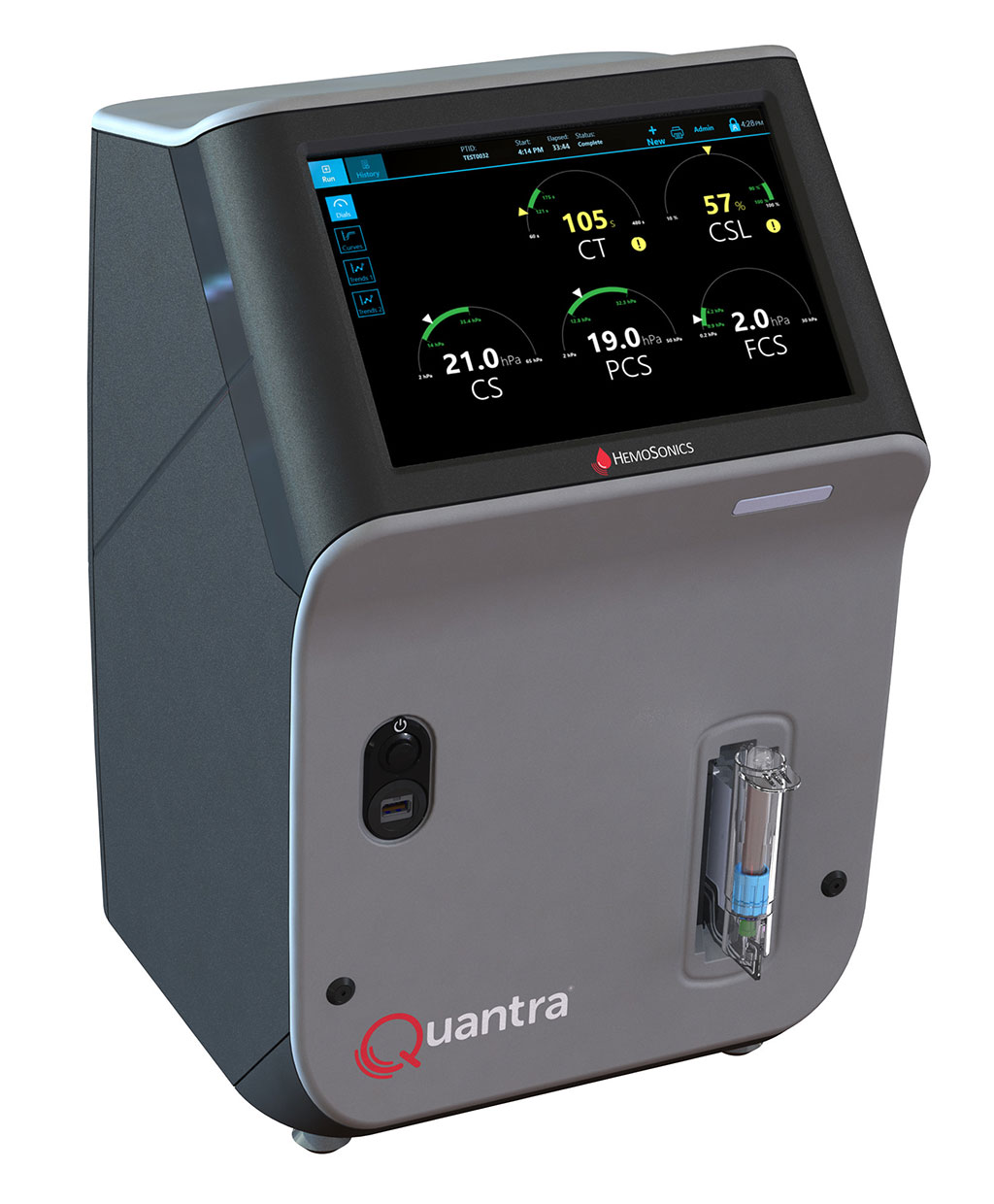
Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
Las pruebas hemostáticas actuales proporcionan solo un subconjunto de la información necesaria, o tardan demasiado en ser útiles en situaciones críticas de hemorragia, lo que... Más
Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
La resistencia a los antimicrobianos (RAM) es la falta de respuesta de las bacterias a un determinado antibiótico debido a mutaciones o genes de resistencia que la especie ha adquirido.... MásNegocios
ver canal
Colaboración ampliada transformará la tecnología en quirófanos mediante IA y automatización
La expansión de una colaboración existente entre tres empresas líderes tiene como objetivo desarrollar soluciones impulsadas por inteligencia artificial (IA) para quirófanos... Más