Comirnaty de Pfizer-BioNTech se convierte en la primera vacuna contra la COVID-19 en recibir la aprobación total de la FDA de los Estados Unidos
|
Por el equipo editorial de HospiMedica en español Actualizado el 30 Aug 2021 |
Image
La Administración de Alimentos y Medicamentos de EUA aprobó la Solicitud de Licencia de Productos Biológicos (BLA) para COMIRNATY (vacuna COVID-19, ARNm) desarrollada conjuntamente por Pfizer Inc. (Nueva York, NY, EUA) y Biopharmaceutical New Technologies (BioNTech Maguncia, Alemania) para prevenir la COVID-19 en personas mayores de 16 años, lo que la convierte en la primera vacuna COVID-19 en recibir la aprobación de la FDA.
COMIRNATY, que se basa en la tecnología de ARNm patentada de BioNTech, contiene ARN mensajero (ARNm), una especie de material genético. El cuerpo utiliza el ARNm para imitar una de las proteínas del virus que causa la COVID-19. El resultado de que una persona reciba esta vacuna es que su sistema inmunológico finalmente reaccionará de manera defensiva al virus que causa la COVID-19. El ARNm de Comirnaty solo está presente en el cuerpo durante un corto período de tiempo y no se incorpora al material genético de un individuo, ni lo altera.
La vacuna ha estado disponible en los EUA bajo una Autorización de Uso de Emergencia (AUE) desde el 11 de diciembre de 2020 (como la vacuna Pfizer-BioNTech COVID-19). La AUE permitió el despliegue esencial de dosis de vacunas en los EUA para ayudar a brindar protección durante la emergencia de salud pública COVID-19, según los datos iniciales del ensayo clínico fundamental de fase 3. Para la aprobación de la FDA, Pfizer y BioNTech presentaron un paquete de datos completo que incluía datos de seguimiento a más largo plazo del ensayo de fase 3, donde se observó la alta eficacia y el perfil de seguridad favorable de la vacuna hasta seis meses después de la segunda dosis. El paquete de presentación de BLA también incluía los datos de fabricación e instalaciones necesarios para obtener la licencia. Pfizer y BioNTech completaron la presentación de la BLA en mayo de 2021, y la BLA recibió una Revisión Prioritaria en julio de 2021.
“Sobre la base de los datos de seguimiento a más largo plazo que presentamos, la decisión de hoy de la FDA afirma el perfil de eficacia y seguridad de nuestra vacuna en un momento en que se necesita con urgencia. Aproximadamente el 60% de los estadounidenses elegibles están completamente vacunados, y las tasas de infección, hospitalización y muerte continúan aumentando rápidamente entre las poblaciones no vacunadas en todo el país”, dijo Albert Bourla, presidente y director ejecutivo de Pfizer. “Espero que esta aprobación ayude a aumentar la confianza en nuestra vacuna, ya que la vacunación sigue siendo la mejor herramienta que tenemos para ayudar a proteger vidas y lograr la inmunidad colectiva. Ya se han administrado cientos de millones de dosis de nuestra vacuna en los EUA desde diciembre de 2020, y esperamos continuar trabajando con el gobierno de EUA para llegar a más estadounidenses ahora que tenemos la aprobación de la FDA”.
“La aprobación total de hoy por parte de la FDA subraya la alta eficacia y el perfil de seguridad favorable de la vacuna”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Nuestras empresas han enviado más de mil millones de dosis en todo el mundo y continuaremos trabajando incansablemente para ampliar el acceso a nuestra vacuna y estar preparados para posibles variantes de escape emergentes”.
“Nuestros expertos médicos y científicos llevaron a cabo una evaluación increíblemente exhaustiva y reflexiva de esta vacuna. Evaluamos los datos científicos y la información incluida en cientos de miles de páginas, realizamos nuestros propios análisis de la seguridad y eficacia de Comirnaty y realizamos una evaluación detallada de los procesos de fabricación, incluidas las inspecciones de las instalaciones de fabricación”, dijo Peter Marks, MD, Ph.D., director del Centro de Evaluación e Investigación de Productos Biológicos de la FDA. “No hemos perdido de vista que la crisis de salud pública de COVID-19 continúa en los EUA y que el público quiere vacunas seguras y efectivas. El público y la comunidad médica pueden estar seguros de que, aunque aprobamos esta vacuna rápidamente, cumplió plenamente con nuestros altos estándares existentes para las vacunas en los EUA”.
Enlace relacionado:
Pfizer Inc.
Biopharmaceutical New Technologies
COMIRNATY, que se basa en la tecnología de ARNm patentada de BioNTech, contiene ARN mensajero (ARNm), una especie de material genético. El cuerpo utiliza el ARNm para imitar una de las proteínas del virus que causa la COVID-19. El resultado de que una persona reciba esta vacuna es que su sistema inmunológico finalmente reaccionará de manera defensiva al virus que causa la COVID-19. El ARNm de Comirnaty solo está presente en el cuerpo durante un corto período de tiempo y no se incorpora al material genético de un individuo, ni lo altera.
La vacuna ha estado disponible en los EUA bajo una Autorización de Uso de Emergencia (AUE) desde el 11 de diciembre de 2020 (como la vacuna Pfizer-BioNTech COVID-19). La AUE permitió el despliegue esencial de dosis de vacunas en los EUA para ayudar a brindar protección durante la emergencia de salud pública COVID-19, según los datos iniciales del ensayo clínico fundamental de fase 3. Para la aprobación de la FDA, Pfizer y BioNTech presentaron un paquete de datos completo que incluía datos de seguimiento a más largo plazo del ensayo de fase 3, donde se observó la alta eficacia y el perfil de seguridad favorable de la vacuna hasta seis meses después de la segunda dosis. El paquete de presentación de BLA también incluía los datos de fabricación e instalaciones necesarios para obtener la licencia. Pfizer y BioNTech completaron la presentación de la BLA en mayo de 2021, y la BLA recibió una Revisión Prioritaria en julio de 2021.
“Sobre la base de los datos de seguimiento a más largo plazo que presentamos, la decisión de hoy de la FDA afirma el perfil de eficacia y seguridad de nuestra vacuna en un momento en que se necesita con urgencia. Aproximadamente el 60% de los estadounidenses elegibles están completamente vacunados, y las tasas de infección, hospitalización y muerte continúan aumentando rápidamente entre las poblaciones no vacunadas en todo el país”, dijo Albert Bourla, presidente y director ejecutivo de Pfizer. “Espero que esta aprobación ayude a aumentar la confianza en nuestra vacuna, ya que la vacunación sigue siendo la mejor herramienta que tenemos para ayudar a proteger vidas y lograr la inmunidad colectiva. Ya se han administrado cientos de millones de dosis de nuestra vacuna en los EUA desde diciembre de 2020, y esperamos continuar trabajando con el gobierno de EUA para llegar a más estadounidenses ahora que tenemos la aprobación de la FDA”.
“La aprobación total de hoy por parte de la FDA subraya la alta eficacia y el perfil de seguridad favorable de la vacuna”, dijo Ugur Sahin, M.D., director ejecutivo y cofundador de BioNTech. “Nuestras empresas han enviado más de mil millones de dosis en todo el mundo y continuaremos trabajando incansablemente para ampliar el acceso a nuestra vacuna y estar preparados para posibles variantes de escape emergentes”.
“Nuestros expertos médicos y científicos llevaron a cabo una evaluación increíblemente exhaustiva y reflexiva de esta vacuna. Evaluamos los datos científicos y la información incluida en cientos de miles de páginas, realizamos nuestros propios análisis de la seguridad y eficacia de Comirnaty y realizamos una evaluación detallada de los procesos de fabricación, incluidas las inspecciones de las instalaciones de fabricación”, dijo Peter Marks, MD, Ph.D., director del Centro de Evaluación e Investigación de Productos Biológicos de la FDA. “No hemos perdido de vista que la crisis de salud pública de COVID-19 continúa en los EUA y que el público quiere vacunas seguras y efectivas. El público y la comunidad médica pueden estar seguros de que, aunque aprobamos esta vacuna rápidamente, cumplió plenamente con nuestros altos estándares existentes para las vacunas en los EUA”.
Enlace relacionado:
Pfizer Inc.
Biopharmaceutical New Technologies
Últimas COVID-19 noticias
- Sistema de bajo costo detecta el virus SARS-CoV-2 en el aire del hospital mediante burbujas de alta tecnología
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- TC del tórax de los pacientes con COVID-19 podrían ayudar a diferenciar entre las variantes del SARS-CoV-2
- Resonancia magnética especializada detecta anormalidades pulmonares en pacientes no hospitalizados con COVID prolongada
- Algoritmo de IA identifica a los pacientes hospitalizados con mayor riesgo de morir por COVID-19
- Estudio evalúa el impacto de la COVID-19 sobre la gammagrafía de ventilación/perfusión
- Sensor de sudor detecta biomarcadores claves que suministran una alarma precoz de la COVID-19 y la influenza
- Modelo de IA para seguimiento de COVID-19 predice mortalidad durante los primeros 30 días del ingreso
- ECG puede señalar pacientes hospitalizados con COVID-19 con riesgo más alto de muerte
- IA predice pronóstico de COVID a un nivel casi experto con base en tomografías computarizadas
- Examen de TC muestra evidencia de daño pulmonar persistente mucho tiempo después de neumonía por COVID-19
- Plataforma órgano-en-un-chip ayuda a diseñar estrategia para tratar complicaciones severas de la COVID-19
Canales
Cuidados Criticos
ver canal
Una cápsula inteligente ingerible detecta sustancias químicas en el intestino
Los gases intestinales se asocian con diversas afecciones, como el cáncer de colon, el síndrome del intestino irritable y la enfermedad inflamatoria intestinal, y tienen el potencial de servir... Más
Nuevo método administra terapias celulares en pacientes críticos con soporte pulmonar externo
Hasta ahora, ha sido prácticamente imposible administrar terapias celulares a pacientes conectados a oxigenación por membrana extracorpórea (ECMO), un sistema de soporte vital utilizado... Más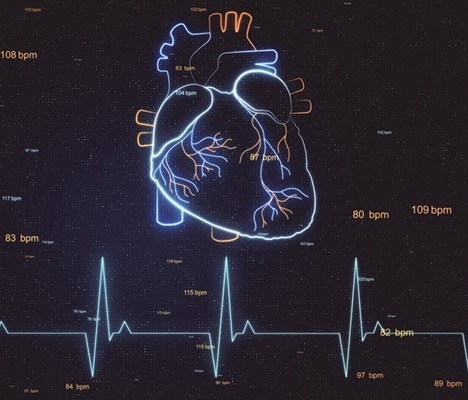
Tecnología de IA generativa detecta enfermedades cardíacas antes que los métodos convencionales
Detectar disfunciones cardíacas de forma temprana utilizando herramientas rentables y de fácil acceso, como los electrocardiogramas (ECG), y derivar eficazmente a los pacientes adecuados... Más
Dispositivo portátil de monitoreo de salud mide los gases emitidos y absorbidos por la piel
La piel desempeña un papel vital en la protección de nuestro cuerpo frente a los elementos externos. Un componente clave de esta función protectora es la barrera cutánea, compuesta por proteínas y grasas... MásTécnicas Quirúrgicas
ver canal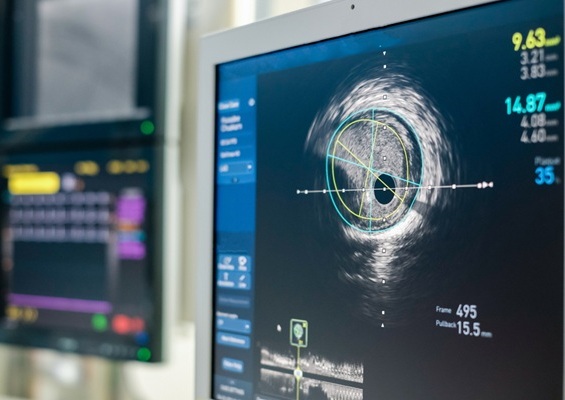
Las imágenes intravasculares mejoran la seguridad en la implantación de stents
Los pacientes diagnosticados con enfermedad coronaria arterial, causada por la acumulación de placa en las arterias, se someten con frecuencia a una intervención coronaria percutánea (ICP).... Más
La primera plataforma de guía quirúrgica con IA permite a los cirujanos medir el éxito en tiempo real
Los cirujanos siempre han enfrentado desafíos para medir su progreso hacia los objetivos quirúrgicos durante los procedimientos. Tradicionalmente, obtener mediciones requería salir... Más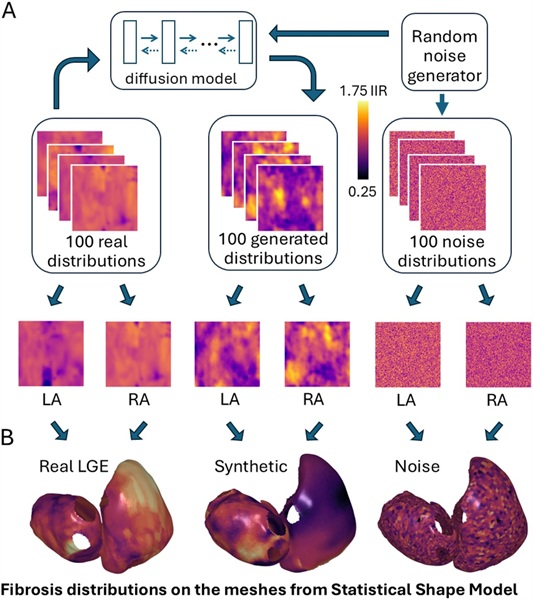
Corazones sintéticos generados por IA ayudan en el tratamiento de la fibrilación auricular
La fibrilación auricular (FA) es un trastorno común del ritmo cardíaco, a menudo asociado con el desarrollo de fibrosis, que consiste en la formación de tejido cicatricial en... Más
Nueva clase de bioadhesivos conecta tejidos humanos a implantes médicos de larga duración
Los dispositivos médicos y los tejidos humanos difieren significativamente en su composición. Mientras que los dispositivos médicos se fabrican principalmente con materiales duros como el metal y el plástico,... MásCuidados de Pacientes
ver canal
Plataforma de biosensores portátiles reducirá infecciones adquiridas en el hospital
En la Unión Europea, aproximadamente 4 millones de pacientes adquieren infecciones asociadas a la atención de la salud (IAAS), o infecciones nosocomiales, cada año, lo que provoca alrededor de 37.... MásTecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
La reducción de las infecciones adquiridas en la atención sanitaria (IAAS) sigue siendo una cuestión apremiante dentro de los sistemas sanitarios mundiales. Sólo en Estados Unidos, 1,7 millones de pacientes... Más
Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
Una solución innovadora tiene la capacidad de transformar la utilización de la capacidad quirúrgica al atacar la causa raíz de las ineficiencias los bloques de tiempo quirúrgico.... Más
Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
Una innovación revolucionaria permite a los hospitales mejorar significativamente el tiempo de procesamiento de instrumentos y el rendimiento en quirófanos y departamentos de procesamiento... MásTI
ver canal
Nanopartículas imprimibles permiten la producción masiva de biosensores portátiles
Es probable que el futuro de la medicina se centre en la personalización de la atención médica, comprendiendo exactamente lo que cada individuo necesita y proporcionando la combinación... Más
Los relojes inteligentes podrían detectar la insuficiencia cardíaca congestiva
El diagnóstico de la insuficiencia cardíaca congestiva (ICC) suele requerir técnicas de diagnóstico por imagen costosas y que consumen mucho tiempo, como la ecocardiografía,... MásPruebas POC
ver canal
Lector de inmunoensayo de pruebas POC proporciona análisis cuantitativo de kits de prueba para diagnóstico más preciso
Un lector de inmunoensayos cuantitativos pequeño y liviano que proporciona un análisis cuantitativo de cualquier tipo de kits o tiras de prueba rápida, y se puede conectar a una PC... Más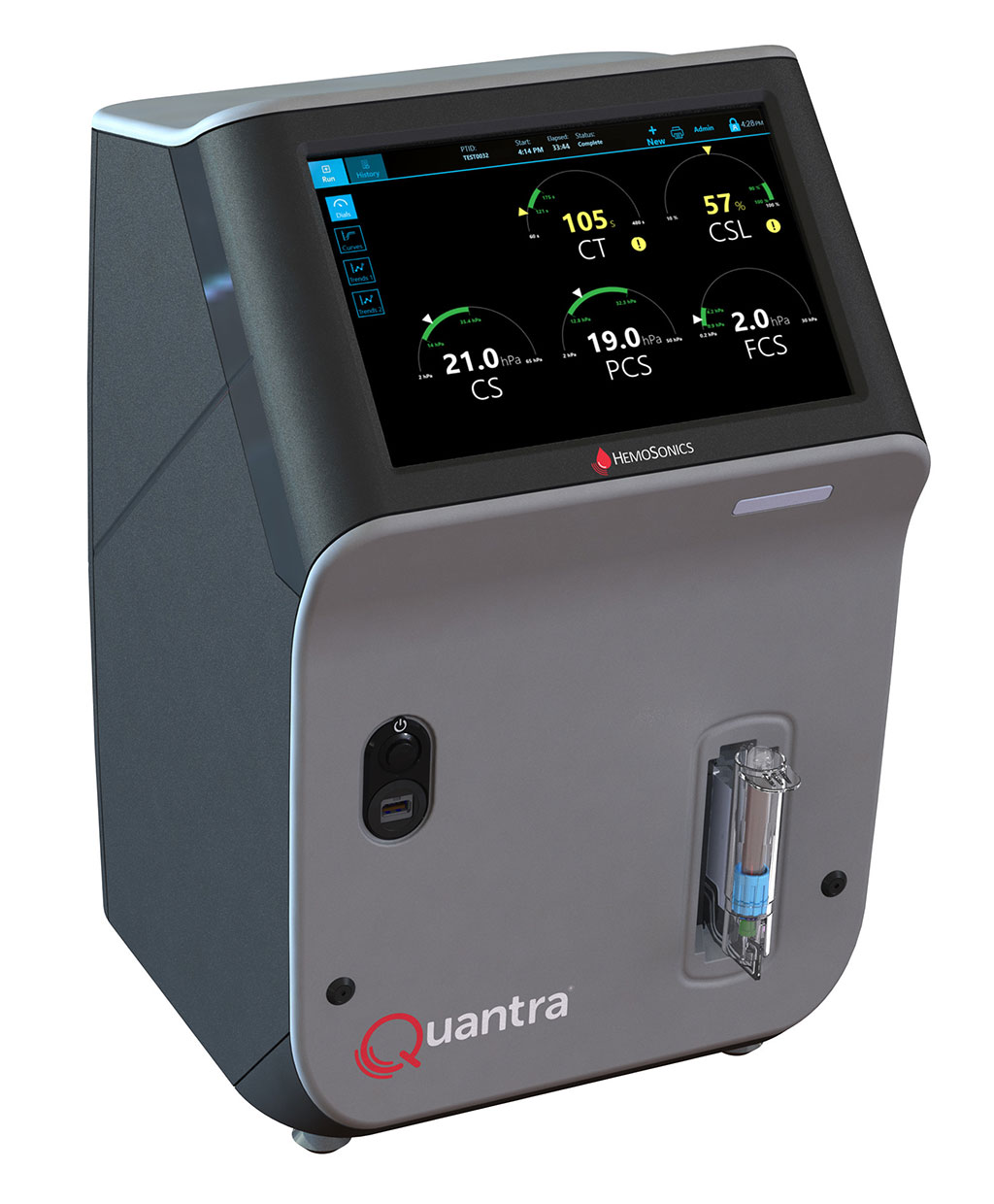
Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
Las pruebas hemostáticas actuales proporcionan solo un subconjunto de la información necesaria, o tardan demasiado en ser útiles en situaciones críticas de hemorragia, lo que... Más
Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
La resistencia a los antimicrobianos (RAM) es la falta de respuesta de las bacterias a un determinado antibiótico debido a mutaciones o genes de resistencia que la especie ha adquirido.... MásNegocios
ver canal
Colaboración ampliada transformará la tecnología en quirófanos mediante IA y automatización
La expansión de una colaboración existente entre tres empresas líderes tiene como objetivo desarrollar soluciones impulsadas por inteligencia artificial (IA) para quirófanos... Más