Ensayo clínico de los NIH para evaluar los anticuerpos y terapéuticos experimentales para la COVID-19
|
Por el equipo editorial de HospiMedica en español Actualizado el 09 Aug 2020 |

Ilustración
Los Institutos Nacionales de Salud (NIH Bethesda, MA, EUA) lanzaron un ensayo clínico de Fase 2 para evaluar la seguridad y la eficacia de posibles terapias nuevas para la COVID-19, que incluye una terapia en investigación basada en anticuerpos monoclonales sintéticos (mAb) para tratar la enfermedad.
Los investigadores patrocinados por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), parte del NIH, trabajaron con sitios clínicos para identificar posibles pacientes voluntarios actualmente infectados con SARS-CoV-2, que tienen una enfermedad leve a moderada que no requiere hospitalización. Se les invitará a tomar una terapia experimental o un placebo, como parte de un ensayo clínico aleatorizado rigurosamente diseñado. La prueba, que se conoce como ACTIV-2, también puede investigar otras terapias experimentales más adelante bajo el mismo protocolo de prueba. ACTIV-2 se estableció como parte de la asociación público-privado, Acelerando las Intervenciones Terapéuticas y Vacunas (ACTIV) contra la COVID-19, de los NIH, un programa creado para acelerar el desarrollo de los tratamientos y vacunas más prometedores. El estudio también recibió apoyo a través de la Operación Warp Speed, el esfuerzo de múltiples agencias del gobierno de los Estados Unidos para desarrollar, fabricar y distribuir contramedidas médicas para combatir la COVID-19.
El ensayo estará dirigido por el Grupo de Ensayos Clínicos sobre el SIDA (ACTG), financiado por el NIAID, e inscribirá a los participantes en sitios de todo el mundo. El diseño del estudio es adaptable para permitir la máxima flexibilidad en el menor tiempo posible. Si los mAb en investigación son prometedores, el estudio se expandiría de una fase 2 a una fase 3 para recopilar datos críticos adicionales de un grupo más grande de voluntarios sin demora. El estudio también se puede adaptar para probar terapias adicionales.
El primer producto terapéutico que se probará en este ensayo será LY-CoV555, un anticuerpo monoclonal en investigación fabricado por Eli Lilly and Company (Indianápolis, Ind, EUA). LY-CoV555 surgió de la colaboración de Lilly con AbCellera Biologics Inc. (Vancouver, Canadá). El anticuerpo, descubierto por AbCellera en colaboración con el Centro de Investigación de Vacunas del NIAID, se aisló de una muestra de sangre de un paciente recuperado de COVID-19. Luego se sintetizaron copias de este anticuerpo en un laboratorio; el término “monoclonal” se refiere a estos anticuerpos fabricados en el laboratorio.
La etapa inicial de la prueba fue diseñada para inscribir aproximadamente a 220 voluntarios que informan haber experimentado recientemente síntomas de COVID-19 y que dan positivo para el virus, pero no están hospitalizados. Los objetivos principales del ensayo de fase 2 son evaluar la seguridad, ver si el agente terapéutico en investigación puede reducir la duración de los síntomas hasta el día 28 del estudio y ver si el agente terapéutico en investigación puede aumentar la proporción de participantes con virus indetectable en hisopados nasofaríngeos en puntos de tiempo específicos. Si no existen problemas de seguridad graves y si el tratamiento terapéutico en investigación parece cumplir con otros criterios específicos (como reducir suficientemente la duración de los síntomas o la carga viral en los cuerpos de los voluntarios), el ensayo pasará a la Fase 3.
“Hemos visto resultados alentadores y rápidos de otros ensayos de tratamiento adaptativo para la COVID-19”, dijo el director de los NIH, Francis S. Collins, M.D., Ph.D. “Bajo ACTIV, se prioriza la terapéutica específica en función de su probabilidad de éxito. La terapéutica priorizada bajo ACTIV utilizará un protocolo maestro que enfatiza la flexibilidad, lo que permite que estos ensayos críticos se lleven a cabo sin incurrir en demoras cuando un tratamiento parece prometedor”.
“El uso de un anticuerpo generado por el sistema inmune de un paciente recuperado de COVID-19, nos da un comienzo rápido para encontrar una terapéutica segura y efectiva”, dijo el director del NIAID, Anthony S. Fauci, MD “Investigar una variedad de diferentes terapias, incluidos los anticuerpos monoclonales, ayudará a garantizar que avancemos hacia un tratamiento efectivo para las personas que padecen la enfermedad COVID-19, lo más rápido posible”.
Enlace relacionado:
Los Institutos Nacionales de Salud
Eli Lilly and Company
AbCellera Biologics Inc.
Los investigadores patrocinados por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), parte del NIH, trabajaron con sitios clínicos para identificar posibles pacientes voluntarios actualmente infectados con SARS-CoV-2, que tienen una enfermedad leve a moderada que no requiere hospitalización. Se les invitará a tomar una terapia experimental o un placebo, como parte de un ensayo clínico aleatorizado rigurosamente diseñado. La prueba, que se conoce como ACTIV-2, también puede investigar otras terapias experimentales más adelante bajo el mismo protocolo de prueba. ACTIV-2 se estableció como parte de la asociación público-privado, Acelerando las Intervenciones Terapéuticas y Vacunas (ACTIV) contra la COVID-19, de los NIH, un programa creado para acelerar el desarrollo de los tratamientos y vacunas más prometedores. El estudio también recibió apoyo a través de la Operación Warp Speed, el esfuerzo de múltiples agencias del gobierno de los Estados Unidos para desarrollar, fabricar y distribuir contramedidas médicas para combatir la COVID-19.
El ensayo estará dirigido por el Grupo de Ensayos Clínicos sobre el SIDA (ACTG), financiado por el NIAID, e inscribirá a los participantes en sitios de todo el mundo. El diseño del estudio es adaptable para permitir la máxima flexibilidad en el menor tiempo posible. Si los mAb en investigación son prometedores, el estudio se expandiría de una fase 2 a una fase 3 para recopilar datos críticos adicionales de un grupo más grande de voluntarios sin demora. El estudio también se puede adaptar para probar terapias adicionales.
El primer producto terapéutico que se probará en este ensayo será LY-CoV555, un anticuerpo monoclonal en investigación fabricado por Eli Lilly and Company (Indianápolis, Ind, EUA). LY-CoV555 surgió de la colaboración de Lilly con AbCellera Biologics Inc. (Vancouver, Canadá). El anticuerpo, descubierto por AbCellera en colaboración con el Centro de Investigación de Vacunas del NIAID, se aisló de una muestra de sangre de un paciente recuperado de COVID-19. Luego se sintetizaron copias de este anticuerpo en un laboratorio; el término “monoclonal” se refiere a estos anticuerpos fabricados en el laboratorio.
La etapa inicial de la prueba fue diseñada para inscribir aproximadamente a 220 voluntarios que informan haber experimentado recientemente síntomas de COVID-19 y que dan positivo para el virus, pero no están hospitalizados. Los objetivos principales del ensayo de fase 2 son evaluar la seguridad, ver si el agente terapéutico en investigación puede reducir la duración de los síntomas hasta el día 28 del estudio y ver si el agente terapéutico en investigación puede aumentar la proporción de participantes con virus indetectable en hisopados nasofaríngeos en puntos de tiempo específicos. Si no existen problemas de seguridad graves y si el tratamiento terapéutico en investigación parece cumplir con otros criterios específicos (como reducir suficientemente la duración de los síntomas o la carga viral en los cuerpos de los voluntarios), el ensayo pasará a la Fase 3.
“Hemos visto resultados alentadores y rápidos de otros ensayos de tratamiento adaptativo para la COVID-19”, dijo el director de los NIH, Francis S. Collins, M.D., Ph.D. “Bajo ACTIV, se prioriza la terapéutica específica en función de su probabilidad de éxito. La terapéutica priorizada bajo ACTIV utilizará un protocolo maestro que enfatiza la flexibilidad, lo que permite que estos ensayos críticos se lleven a cabo sin incurrir en demoras cuando un tratamiento parece prometedor”.
“El uso de un anticuerpo generado por el sistema inmune de un paciente recuperado de COVID-19, nos da un comienzo rápido para encontrar una terapéutica segura y efectiva”, dijo el director del NIAID, Anthony S. Fauci, MD “Investigar una variedad de diferentes terapias, incluidos los anticuerpos monoclonales, ayudará a garantizar que avancemos hacia un tratamiento efectivo para las personas que padecen la enfermedad COVID-19, lo más rápido posible”.
Enlace relacionado:
Los Institutos Nacionales de Salud
Eli Lilly and Company
AbCellera Biologics Inc.
Últimas COVID-19 noticias
- Sistema de bajo costo detecta el virus SARS-CoV-2 en el aire del hospital mediante burbujas de alta tecnología
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- TC del tórax de los pacientes con COVID-19 podrían ayudar a diferenciar entre las variantes del SARS-CoV-2
- Resonancia magnética especializada detecta anormalidades pulmonares en pacientes no hospitalizados con COVID prolongada
- Algoritmo de IA identifica a los pacientes hospitalizados con mayor riesgo de morir por COVID-19
- Estudio evalúa el impacto de la COVID-19 sobre la gammagrafía de ventilación/perfusión
- Sensor de sudor detecta biomarcadores claves que suministran una alarma precoz de la COVID-19 y la influenza
- Modelo de IA para seguimiento de COVID-19 predice mortalidad durante los primeros 30 días del ingreso
- ECG puede señalar pacientes hospitalizados con COVID-19 con riesgo más alto de muerte
- IA predice pronóstico de COVID a un nivel casi experto con base en tomografías computarizadas
- Examen de TC muestra evidencia de daño pulmonar persistente mucho tiempo después de neumonía por COVID-19
- Plataforma órgano-en-un-chip ayuda a diseñar estrategia para tratar complicaciones severas de la COVID-19
Canales
Cuidados Criticos
ver canal
Herramienta de IA identifica pacientes con trauma que requieren transfusiones de sangre
El sangrado grave es una de las causas más comunes y prevenibles de muerte tras una lesión traumática. Sin embargo, las herramientas actuales a menudo no identifican con precisión... Más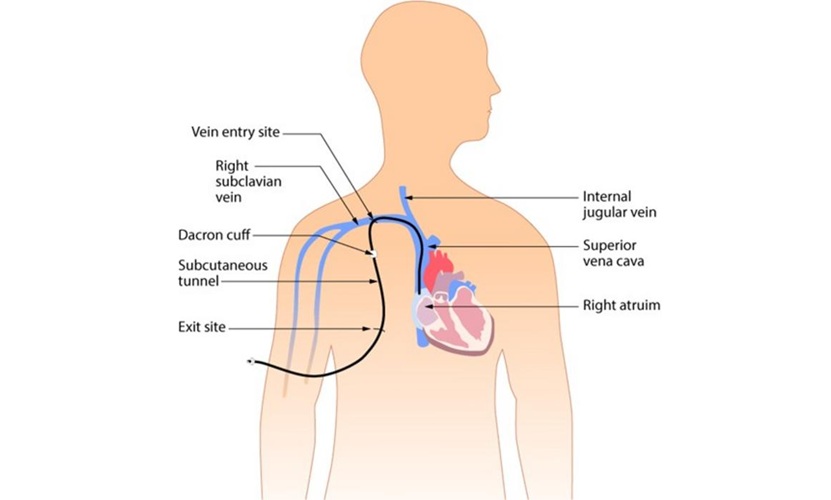
Nuevas guías clínicas ayudan a reducir las infecciones del torrente sanguíneo asociadas a catéteres centrales
Los catéteres venosos centrales son esenciales en las unidades de cuidados intensivos (UCI), ya que administran medicamentos vitales, monitorizan la función cardiovascular y favorecen la... MásTécnicas Quirúrgicas
ver canal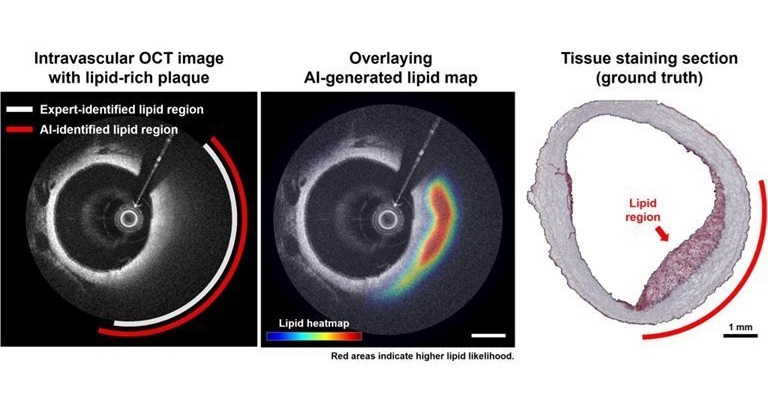
Análisis de imágenes OCT basado en IA identifica placas de alto riesgo en arterias coronarias
Las placas ricas en lípidos dentro de las arterias coronarias están fuertemente asociadas con ataques cardíacos y otros eventos cardíacos mayores. Si bien la tomografía... Más
Dispositivo neural estimula la regeneración del cráneo tras implante cerebral
La colocación de implantes electrónicos en el cerebro suele requerir la extirpación de una parte del cráneo, lo que dificulta el acceso a largo plazo y el cierre seguro. Los métodos actuales suelen implicar... MásCuidados de Pacientes
ver canal
Dispositivo automático de lavado de vías intravenosas mejora la atención en infusiones
Más del 80% de los pacientes hospitalizados reciben terapia intravenosa (IV). Cada dosis de medicamento IV administrada en una bolsa de infusión de pequeño volumen (<250 mL) debe... Más
Herramienta de capacitación en realidad virtual combate la contaminación de equipos médicos portátiles
Las infecciones asociadas a la atención médica (IAAS) afectan a uno de cada 31 pacientes, causan casi 100.000 muertes al año y generan un costo de 28.4 mil millones de dólares... Más
Plataforma de biosensores portátiles reducirá infecciones adquiridas en el hospital
En la Unión Europea, aproximadamente 4 millones de pacientes adquieren infecciones asociadas a la atención de la salud (IAAS), o infecciones nosocomiales, cada año, lo que provoca alrededor de 37.... MásTecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
La reducción de las infecciones adquiridas en la atención sanitaria (IAAS) sigue siendo una cuestión apremiante dentro de los sistemas sanitarios mundiales. Sólo en Estados Unidos, 1,7 millones de pacientes... MásTI
ver canal
Herramienta basada en HCE predice el fallo del injerto tras un trasplante de riñón
El trasplante de riñón ofrece a los pacientes con enfermedad renal terminal una mayor supervivencia y mejor calidad de vida que la diálisis. Sin embargo, el fallo del injerto sigue... Más
Nanopartículas imprimibles permiten la producción masiva de biosensores portátiles
Es probable que el futuro de la medicina se centre en la personalización de la atención médica, comprendiendo exactamente lo que cada individuo necesita y proporcionando la combinación... MásPruebas POC
ver canal
Lector de inmunoensayo de pruebas POC proporciona análisis cuantitativo de kits de prueba para diagnóstico más preciso
Un lector de inmunoensayos cuantitativos pequeño y liviano que proporciona un análisis cuantitativo de cualquier tipo de kits o tiras de prueba rápida, y se puede conectar a una PC... Más
Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
Las pruebas hemostáticas actuales proporcionan solo un subconjunto de la información necesaria, o tardan demasiado en ser útiles en situaciones críticas de hemorragia, lo que... Más
Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
La resistencia a los antimicrobianos (RAM) es la falta de respuesta de las bacterias a un determinado antibiótico debido a mutaciones o genes de resistencia que la especie ha adquirido.... MásNegocios
ver canal
Philips y Masimo se asocian para impulsar las tecnologías de monitorización de pacientes
Royal Philips (Ámsterdam, Países Bajos) y Masimo (Irvine, CA, EUA) han renovado su colaboración estratégica plurianual, combinando la experiencia de Philips en monitorización... Más